产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
卵巢癌临床新药Rucaparib获得FDA优先评审资格
2016-08-29
来源:转载自第三方
2016年08月29日/苏州亚科科技行业资讯
卵巢恶性肿瘤是女性生殖器官常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而列居第三位。而且根据美国癌症协会, 美国将有22,000 名女性于2016年被诊断出卵巢癌。Clovis Oncology近日发表声明,宣布FDA已接受其卵巢癌临床新药Rucaparib的加速审批申请,并赋予其优先评审资格。评审结果将于2017年二月底给出。而在欧洲药品管理局的上市许可申请计划于2016年第四季度完成.
复发性卵巢癌一直是非常难治愈的,尤其是带有BRCA基因的人群。尽管目前已经有治疗方案,但效果仍然有限。因此,使用Rucaparib来治疗带有BRCA基因突变和已接受至少两种化疗方法的患者,是具有重大意义的进步。
Rucaparib是一种正在开发的针对晚期卵巢癌的口服小分子药物,是PARP1、PARP2和PARP3这三种酶的抑制剂。它通过抑制聚腺苷二磷酸核糖聚合酶类(PARPs)而发挥作用,可以阻碍能使癌症在全身扩散的某些基因突变的发生。目前处于2期临床,并已于去年四月被美国FDA赋予突破性药物资格认定。
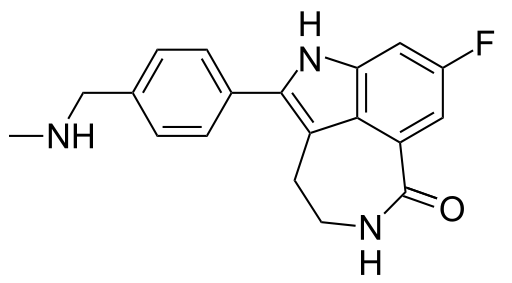
Rucaparib结构式(图片来自wikipedia)
Clovis Oncology 总裁兼CEO,Patrick J. Mahaffy 说“FDA接受了新药申请,不管对Rucaparib还是对Clovis来说,都是一个重要的里程碑,携带有BRCA卵巢癌基因的患者迫切需要更多的治疗方法。我们期待与FDA在新药评审上的合作。”
尽管阿斯利康公司的Lynparza最近将公布最新研究数据并有望获得FDA的完全批准,但是在Clovis公司CEO Patrick Mahaffy看来,已难撼动rucaparib的优势地位。FDA此次的举动无疑是在两者中选择了Rucaparib,受此消息影响,连Clovis公司的股价也上涨了10%左右。
相关链接: Rucaparib
本文由苏州亚科科技股份有限公司编辑
如果涉及转载授权,请联系我们。












