产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
单基因发文14+!研究放疗如何下手
本文转自生信人
这是一篇近期发表在Theranostics(IF: 12.4)的文章,该文章主要展示了如何通过转录组测序+湿实验相结合的方式,探究首次揭示了宿主基因MIR222HG促进胶质母细胞瘤(GBM)放疗耐受及免疫微环境抑制的新机制。

背景
胶质母细胞瘤(Glioblastoma, GBM)是颅内最常见的原发性恶性肿瘤,具有易耐药和预后差的特点。GBM难以根治的主要原因不仅是肿瘤难以切除干净,还与肿瘤的放疗耐受和免疫抑制性微环境密切相关。胶质瘤干细胞(GSC)是胶质母细胞瘤(GBM)发展和治疗耐药性的关键因素。GSCs可分为间充质(MES)亚型和原神经(PN)亚型,这两种GSC亚型在一定条件下可以发生相互转化。MES GSC(mGSC)具有较高的肿瘤恶性程度和放疗耐受,并且与免疫抑制微环境密切相关。长链非编码RNA(lncRNA)在GBM中起广泛作用,而GSCs亚型的作用仍然未知。
在GBM恶性进展过程中,GSCs的前膜向间充质转化(PMT)是导致放疗耐受和肿瘤复发的主要原因,作者将GBM放疗耐受研究巧妙地转化为研究GSCs的前膜-间充质转化,此外,lncRNA的表达谱可以反映GSCs内在的PN和MES亚型特征,但lncRNA是否参与GSCs的PMT尚未深入研究,作者大事化小,放疗耐受研究最后聚焦到参与放疗耐受机制的LncRNA。在该研究中,作者通过比较GBMs和GSCs的PN和MES亚型之间lncRNA的差异表达,发现MIR222HG在MES亚型中高表达。湿实验证实MIR222HG能促进GSC从PN型向MES型转化进而产生放疗耐受性,此外与MIR222HG-201共转录的miR221和miR222可从胶质瘤干细胞中通过外泌体作用于巨噬细胞,引起巨噬细胞的免疫抑制。在这些产物中,最丰富的lncRNA转录物MIR222HG-201通过锚定组蛋白H4在GSCs细胞核中募集组蛋白去乙酰化酶5 (HDAC5)/YWHAE复合物,介导H4K16的去乙酰化,导致GSCs的PMT,从而增强辐射抗性。共转录的miR221和miR222可以通过外泌体从GSCs转移到巨噬细胞,介导SOCS3表达的降低,导致巨噬细胞的免疫抑制极化。SPI1作为MIR222HG基因的转录因子,介导lncRNAs和miRNAs的共转录,导致GSCs的PMT和巨噬细胞的免疫抑制极化。
最后,作者使用PLX-4720筛选与SPI1表达相关的GBM细胞敏感性。这些实验证实了mGSCs对PLX-4720敏感,与放疗联合使用可显著提高治疗效果。
结果
1.MIR222HG促进GSC自我更新且介导GSCs的PMT
作者研究对象为具有调节PMT功能的LncRNA,使用ssGSEA方法,对12个GBM样本RNA数据进行基因集计算MES和PN评分,为了探索可能调节PMT的lncrna,我们使用ssGSEA方法,利用来自齐鲁医院神经外科(GEO: GSE211554)的12个GBM样本测序数据中的Phillips基因集计算MES和PN评分,并将样本分为High-Score和low - score两组进行差异分析,High-low两组差异表达基因、TCGA数据库中的MES GBM和PN GBM中差异表达的基因、ENA中MES GSCs和PN GSCs中差异表达LncRNA基因,三者取交集。从中鉴定出在MES亚型7个高表达的LncRNA。接下来,RT-PCR细胞系进行验证得到MIR222HG高表达,同预测一致。即与神经原始细胞相比,在GBMs中表达增加,在GBMs中的MES亚型表达特异性增加。TCGA数据库基因相关性分析显示:MIR222HG的表达与MES亚型标记基因的表达呈正相关,进一步证实了MIR222HG在GBMs MES中的高表达。作者从单细胞数据层及GSEA层再次证实了这一点。MIR222HG在GBM中主要以MIR222HG-201和MIR222HG-202两个转录本表达,转录本MIR222HG201表达量更高。生存分析显示,MIR222HG-201高表达患者预后较差,低表达患者预后较好。通过FISH和核细胞质分离证实MIR222HG是一个定位于细胞核的lncRNA。
体外湿实验证据:敲除mGSCs中的MIR222HG的western blot发现MES标记CD44的表达显著降低,PN标记SOX2的表达显著增加。MIR222HG过表达的pGSCs显示SOX2表达显著降低。通过慢病毒转导细胞系、神经球形成实验和ELDA显示,mGSCs中MIR222HG的下调显著降低了其自我更新能力,而pGSCs中MIR222HG的过表达增强了其自我更新能力。这表明MIR222HG通过增强GSCs的自我更新能力来促进GBM的恶性进展。
体内实验证据,通过异种移植模型,MIR222HG的敲低可以显著降低GSC267细胞的肿瘤发生率,延长小鼠的存活时间,HE染色显示肿瘤侵袭性显著降低。以上证明MIR222HG的过表达增强了GSC8-11细胞的致瘤性和侵袭性,降低了小鼠的存活率和SOX2的表达。综上所述,作者发现核转录物MIR222HG-201在MES亚型中高表达,介导PMT过程,增强GSCs的自我更新能力和致瘤性。

图1
2.MIR222HG的表达与mGSCs的放疗耐受相关
既往研究表明MES GSC具有较高的肿瘤恶性程度和放疗耐受,第二部分内容作者聚焦在mir222hg介导的MES亚型是否协调了GSC放疗耐受性的获得。
作者发现,放疗后GSCs表现出DNA损伤、G2/M阻滞和凋亡。与pGSCs相比,mGSCs在放疗后表现出更少的凋亡、G2/M阻滞和DNA损伤(图A,B,C)。此外,mGSCs中MIR222HG的下调增强了对放疗的应答。相反,pGSCs中MIR222HG的过表达会减弱对放疗的应答。体内实验证明,mGSCs中MIR222HG的敲低增强了mGSCs的放疗应答,减轻了肿瘤的发生,延长了mGSCs小鼠的生存期(图2D,E)。通过小鼠脑的HE切片,作者发现敲除MIR222HG联合放疗可显著降低肿瘤侵袭性(图2F)。组织切片的TUNEL实验也表明,MIR222HG的敲低促进体内mGSCs的凋亡(图2G)。相反,植入过表达MIR222HG的pGSCs的小鼠对放疗的反应性降低,肿瘤生长加快,放疗后存活时间缩短。脑切片HE染色显示,植入过表达MIR222HG的pGSCs并接受放疗组的肿瘤侵袭性显著增加。TUNEL实验表明,MIR222HG的过表达降低了体内肿瘤细胞的凋亡水平(图2G)。综上所述,MIR222HG在体内和体外均增强了mGSCs的放疗耐受性。

图2
3.MIR222HG通过介导H4K16去乙酰化诱导PMT
核定位MIR222HG特异性参与PMT已经明确,聚焦其中机制。作者对MIR222HG敲低的GSC267细胞进行了RNA测序,并通过RNA敲低分离出与MIR222HG结合的蛋白进行质谱分析。RNA-seq数据的GSEA (GEO: GSE213310)表明,MIR222HG在转录组水平上介导GSC中的PMT(图3A).核内LncRNA可通过组蛋白修饰参与调节转录水平,质谱分析结果证明,MIR222HG可以结合组蛋白H4(图3B)。鉴于RNA-seq数据中没有发现与组蛋白相对应的组蛋白修饰酶,作者推测在质谱数据中可能存在参与组蛋白修饰的中间蛋白。通过STRING数据库预测与所有剩余核内蛋白的相互作用,作者发现只有YWHAE可以与组蛋白修饰酶HDAC5结合(图3C)。因此,作者推测MIR222HG可能通过YWHAE与HDAC5的结合修饰H4参与PMT。组蛋白去乙酰化是促进肿瘤发展的重要因素已是不争的事实。先前研究已证实,组蛋白去乙酰化可促进GSC生长并增强MES亚型。HDAC5是一种负责组蛋白去乙酰化的酶,作者假定,MIR222HG可能通过YWHAE与HDAC5的结合修饰H4参与PMT,并进行下游机制验证,作者使用RNAfold WebServer对MIR222HG的二级结构进行预测表明,YWHAE与MIR222HG的二级结构2(核苷酸230-750)结合,H4与MIR222HG的二级结构3(核苷酸750-1150)结合(图3D)。并且再次使用RIP实验验证了MIR222HG与YWHAE和H4的结合。Co-IP证实了YWHAE与HDAC5的结合以及H4与HDAC5的结合(图3F,G,I)。Western blotting结果显示,敲低MIR222HG后,YWHAE和HDAC5的表达没有变化,RNA-seq结果也未观察到转录水平上YWHAE和HDAC5的表达变化,提示MIR222HG不影响细胞内YWHAE和HDAC5的含量(图J)。
为了确定MIR222HG、YWHAE、HDAC5协同作用于H4的具体位点,作者在敲除MIR222HG后,通过Western blotting发现H4K16的乙酰化水平显著升高,说明MIR222HG、YWHAE、HDAC5的联合作用主要导致H4K16的去乙酰化(图3H)。敲低和过表达MIR222HG来检测YWHAE、HDAC5和H4之间的结合亲和力。Co-IP结果显示,H4对HDAC5的结合亲和力在敲低MIR222HG后降低,在过表达MIR222HG后升高(图3K,L)。无论是敲低MIR222HG还是过表达MIR222HG, YWHAE对HDAC5的结合亲和力都没有明显变化,说明MIR222HG不影响YWHAE与HDAC5的结合(图3M, N)。
综上所述,这些结果表明MIR222HG通过二级结构3锚定在H4上,然后通过二级结构2与YWHAE/HDAC5复合物结合,导致H4K16的去乙酰化。

图3
4.MIR222HG通过H4K16去乙酰化激活STAT3和MAPK通路诱导PMT
作者进一步探究mir222hg通过YWHAE/ HDAC5复合物介导的H4K16去乙酰化后下游通路的变化,基于先前测序结果的富集分析显示,MIR222HG的敲低导致MAPK和JAK-STAT通路的变化(图4A)。STAT3通路已被广泛记录为与MES亚型相关的经典通路,而ERK-MAPK通路先前已被证明是促成GSCs的MES样亚型状态的关键因素。作者通过干扰MIR222HG复合体中的两个关键蛋白YWHAE和HDAC5,验证下游通路的变化。Western blot分析证实,MIR222HG过表达后P-ERK1/2和P-STAT3水平显著升高,而敲低YWHAE或HDAC5可减弱P-ERK1/2和P-STAT3的升高,联合敲低YWHAE和HDAC5进一步降低P-ERK1/2和P-STAT3水平。MIR222HG过表达导致H4K16乙酰化增强,CD44表达升高,SOX2表达降低。敲低YWHAE或HDAC5部分逆转了这些变化,YWHAE和HDAC5联合敲低进一步逆转了H4K16ac、CD44和SOX2水平的变化(图4B)。MIR222HG的过表达增强了GSC的自我更新,YWHAE或HDAC5的敲低部分逆转了这种变化,联合敲低YWHAE和HDAC5的进一步逆转了这种变化(图4C)。细胞凋亡和细胞周期实验表明,过表达MIR222HG后GSCs对放疗的抗性增加被YWHAE或HDAC5的敲低部分逆转,YWHAE和HDAC5的联合敲低进一步逆转(图4D)。
综上所述,MIR222HG通过YWHAE/HDAC5介导H4K16的去乙酰化,激活STAT3和ERK-MAPK通路,进而导致PMT并增强GSCs的化疗耐受。
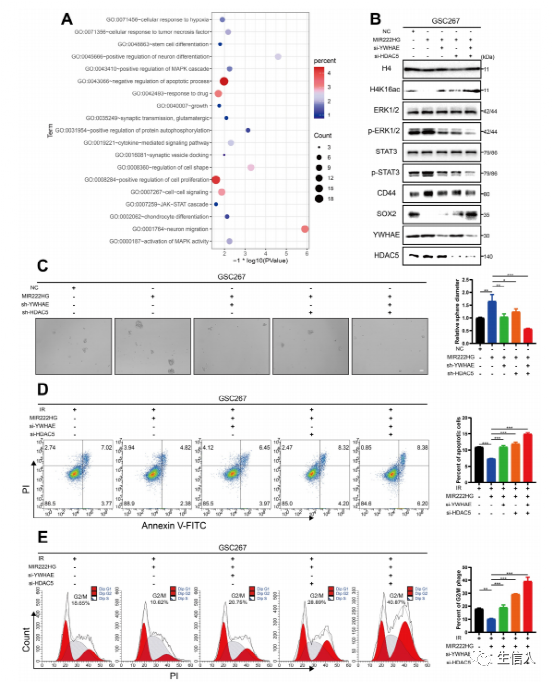
图4
5.GSCs中miR221和miR222的共转录通过外泌体导致巨噬细胞的免疫抑制状态
微环境中的TAM促进GBM的恶性进展,而GBM反过来又促进TAM的免疫抑制极化。既往研究已证实免疫抑制的M2巨噬细胞可以将miR-221-3p、miR-22-3p和miR-27a-3p传递到GSCs,从而促进GSCs中的PMT。qRT-PCR结果显示,MIR222HG基因共转录的miRNA-221-3p和miRNA222-3p不仅在mGSCs中高表达,而且检测到也在其外泌体中。因此,作者假设mGSCs可以通过外泌体向TAM传递miRNA-221-3p和miRNA222-3p来影响巨噬细胞状态。首先证实来自GSCs的外泌体可以被巨噬细胞吞噬(摄取实验)。流式细胞分析显示,来自GSCs的外泌体诱导免疫抑制巨噬细胞标志物CD163的表达,并且mGSCs比pGSCs更强烈地诱导外泌体的释放(图5B)。作者通过qRT-PCR检测了上述处理后巨噬细胞中CD163、TGFB1、IL1RA、IL10、ARG1、PD-L1等一系列巨噬细胞源性免疫抑制基因的表达变化,发现这些基因的表达变化与流式细胞术鉴定的结果基本一致(图5C)。这一发现表明,在mGSCs中高表达的miR221和miR222可以通过外泌体作用于巨噬细胞,导致巨噬细胞的免疫抑制极化。
接下来,作者致力于研究miR221和miR222作用于巨噬细胞的具体机制。有研究表明miR221和miR222可作用于SOCS3抑制GBM中的血管生成,SOCS3作为肿瘤抑制因子与中枢神经系统(CNS)免疫相关,SOCS3的抑制又可导致巨噬细胞的免疫抑制M2极化。使用ENCORI分析miR221和miR222序列,发现它们具有SOCS3 3 '非翻译区(UTR)的共同结合位点(图5D)。我们通过荧光素酶报告基因试验验证了miR221和miR222中SOCS3的结合位点(图5E)。直接过表达miR221和miR222并进一步过表达SOCS3的巨噬细胞流式细胞分析显示,过表达miR221和miR222增加了巨噬细胞中CD163的表达。SOCS3过表达部分逆转了miR221和miR222过表达引起的CD163表达增加(图5G)。qRT-PCR显示这些巨噬细胞中免疫抑制基因CD163、TGFB1、IL1RA、IL10、ARG1和PD-L1的水平变化,与流式细胞术结果基本一致(图5F)。最后,作者验证miR221和miR222通过SOCS3影响免疫抑制性巨噬细胞极化的下游途径,miR221和miR222过表达导致P-STAT3升高,P-P65水平降低,而SOCS3进一步过表达逆转了miR221和miR222过表达引起的变化。
综上所述,这些结果表明,在mGSCs中高表达的miR221和miR222可以通过外泌体作用于巨噬细胞的SOCS3,改变STAT3和NF-κB通路,导致巨噬细胞的免疫抑制极化。
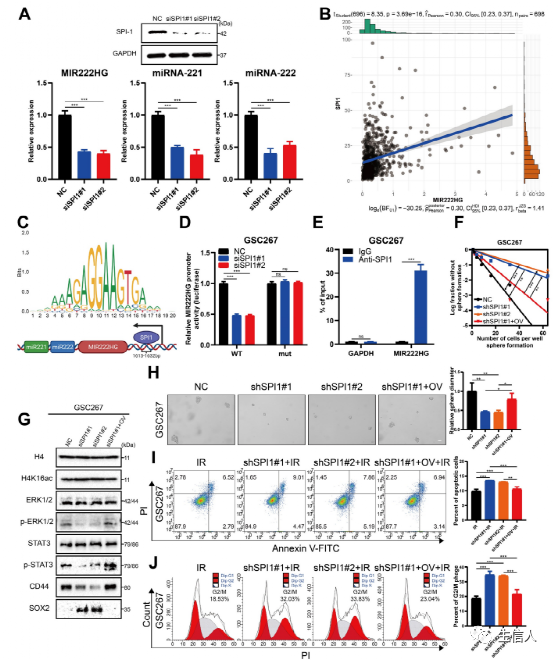
图5
6.转录因子SPI1调控MIR222HG基因的共转录
接下来,作者聚焦调节MIR222HG、miR221和miR222表达的常见上游靶点。使用JASPAR,预测了MIR222HG基因的转录因子,并初步确定了11个潜在的转录因子。通过生信分析这些转录因子与预后、亚型和免疫特性的关系,我们最终将转录因子SPI1作为目标。基于Verhaak和Phillips基因集的GSEA显示,SPI1的高表达在MES亚型中更为普遍,而SPI1的低表达在PN亚型中更为普遍(图S5A, B)。基于标记基因相关性分析,SPI1表达与MES亚型标记基因(CD44、CHI3L1、SERPINE1)表达呈正相关,与PN亚型标记基因(DLL3、OLIG2、ASCL1、NCAM1)表达负相关(图S5C)。在TCGA和CGGA数据库中,SPI1在MES亚型中均有高表达,且SPI1的高表达与预后不良相关。单细胞RNA-seq分析显示,SPI1高表达的细胞群具有更高的MES评分,此外,SPI1在GBM中的高表达与多种免疫特征和途径相关(图S5G、H)。对MIR222HG可能的转录因子SPI1的序列分析显示,它在MIR222HG基因上游的1613-1632位上只有一个结合位点。相关分析显示MIR222HG表达与SPI1表达呈正相关(图6B)。荧光素酶报告基因和ChIP实验表明,SPI1通过结合MIR222HG基因上游1613-1632位促进MIR222HG的转录(图6D、E)。在SPI1敲低后,MIR222HG、miR221和miR222的表达下调(图6A)。作者发现SPI1的敲低降低了GSC20和GSC267细胞的自我更新能力,而MIR222HG的过表达逆转了这一变化(图6F、H)。在GSC20和GSC267细胞中,敲低SPI1后放疗抗性的降低在MIR222HG过表达后被逆转(图6I、J)。
Western blot分析显示,SPI1的敲低增加了H4K16乙酰化水平,降低了ERK1/2和STAT3磷酸化水平。GSC20和GSC267细胞中SOX2表达升高,CD44表达降低,而MIR222HG过表达逆转了这些变化(图6G)
综上所述,这些发现表明SPI1作为转录因子介导MIR222HG、miR221和miR222的共转录,从而引起下游的变化。
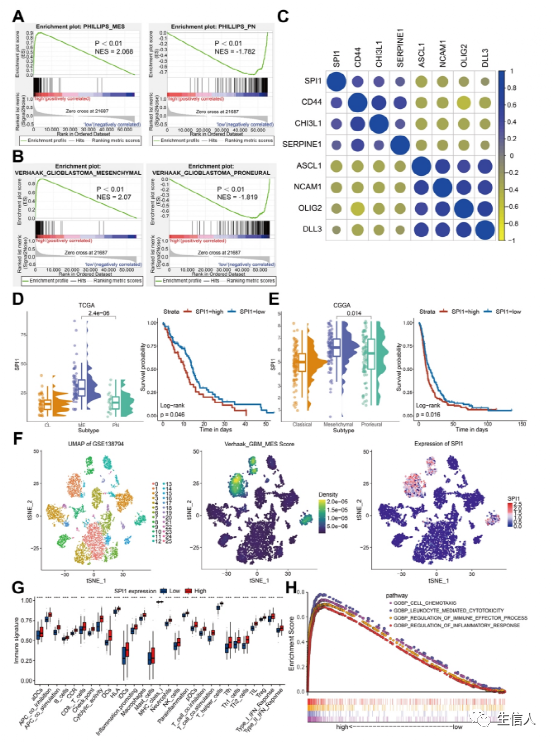
图5S

图6
7.SPI1表达敏感药物PLX-4720联合放疗靶向mGSCs
由于介导MIR222HG转录的SPI1在MES亚型中高表达,我们研究了SPI1表达与治疗药物敏感性的关系。通过筛选SPI1高表达的GBM细胞系敏感的药物,并考虑血脑屏障等因素,最终鉴定出PLX-4720。PLX-4720是一种B-Raf抑制剂,已被证明在体外和体内联合放疗发挥抗gbm作用[43]。我们通过CCK-8实验测定了PLX-4720在GSC20和GSC267细胞中的IC50(图7B)。通过使用PLX-4720或放疗治疗GSC20和GSC267细胞,我们发现PLX-4720的疗效优于单独放疗,导致DNA损伤增加,细胞凋亡增加,G2/M阻滞明显。PLX-4720联合放疗可以使GSCs中DNA损伤和凋亡的进一步增加以及进一步的G2/M阻滞(图7C,D,E)。这些结果表明,PLX-4720对放射耐药的mGSCs具有显著的治疗作用。

图7
结论
1.SPI1在GSCs中调控核Lnc-MIR222HG-201,通过YWHAE与HDAC5结合,锚定H4,介导H4K16去乙酰化,激活STAT3和MAPK通路,从而引起PMT,增强GSCs的放疗耐受性。
2.共转录的miR221和miR222通过外泌体作用于巨噬细胞,导致SOCS3下调,STAT3通路激活,NF-κB通路抑制,导致巨噬细胞免疫抑制极化。
3.SPI1表达敏感药物PLX-4720对放疗耐受的mGSCs具有显著的治疗效果。我们的研究结果表明,靶向MIR222HG基因可能是预防PMT、激活免疫和克服GBM放疗耐受的一种有希望的方法。












