产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
收藏!最详细的纳米抗体制备方法
本文转自康体生命 医麦客
抗体是由免疫B细胞受到抗原刺激产生的能够特异性和抗原结合进而中和抗原的生物蛋白质分子。由于抗体能够特高异性高亲和地结合抗原,抗体一直都是生物医学领域的核心分子之一,广泛应用在学术研究、疾病诊断以及医学药物各个方面。
传统抗体分子(IgG)是一种结构相当保守的由两条相同的重链和两条相同的轻链组成。抗体分子的轻链包含1个VL区和1个CL区,而重链则拥有1个VH区和3个CH区(CH1、CH2和CH3)。
VH区和VL区之间通过二硫键相互连接形成抗体的可变区(Fv),是抗体识别抗原的最小单位,抗体可变区的序列差异决定了抗体能够特异地识别不同的抗原。而CL区和CH区则是相对保守的,被称为抗体的恒定区,其中CH区的CH2和CH3两个区域对于抗体招募免疫细胞发挥ADCC和CDC功能有着重要的作用。
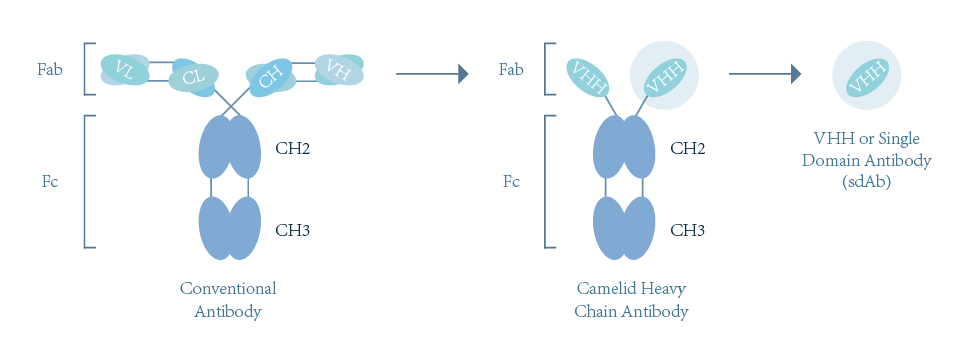
单域抗体(SdAb)为驼类和软骨鱼类中天然存在的仅由两条重链组成的特殊抗体,只包含一个重链可变区(VHH, Variable Domain of Heavy Chain Antibody)和两个常规的CH2与CH3区。单域抗体通过重链上的一个可变区(VHH)结合抗原,该可变区可以单独稳定地在体外存在,被称为驼类单域抗体(SdAb)或者纳米抗体(nanobody)。纳米抗体晶体宽为2.5nm,长4nm,分子量仅为传统完整抗体的1/10(约15kD)但依然具有完整的抗原识别能力,一般通过噬菌体筛选得到完整抗体序列。
得益于纳米抗体微小的结构、完整的抗原识别能力以及噬菌体筛选技术,纳米抗体表现出高亲合力、高特异性、强穿透性和易于改造和表达等特点,并且由于可以获得抗体完整序列,纳米抗体可以通过体外重组表达高质量稳定生产,有效避免传统抗体的批次间差异问题。
和传统抗体相比,纳米抗体分子量小,结构简单。而得益于分子量小的优势,纳米抗体更进一步具有多个特征,使得纳米抗体在新药物发现方面表现出巨大的潜力:
(1)和靶点结合特异性更强;(2)更高的组织穿透力;(3)更高的稳定性;(4)适合工业化大规模生产;(5)更容易体外改造和优化;(6)更容易人源化

由于纳米抗体的这些特征,越来越多的研究机构和药物生产企业在不同的场景中关注、尝试使用纳米抗体。而纳米抗体的开发不同于传统单克隆抗体通过杂交瘤制备的方法,它一般通过免疫羊驼、构建噬菌体文库和通过噬菌体展示来筛选制备。下面,我们将详细讲述推荐的实验方法制备纳米抗体的流程以及其中的关键点和操作技巧,其中的每一个步骤均由深圳康体生命经过多次优化和总结,供有需要和想尝试纳米抗体的机构参考。

免疫羊驼制备单域抗体
单域抗体的获得现在普遍通过免疫羊驼并通过羊驼体内自身的抗体成熟阶段来得到抗体基因,然后通过噬菌体展示筛选技术来从羊驼抗体库中筛选得到最适合的抗体序列。整个流程主要包括羊驼免疫、噬菌体文库构建和抗体筛选三个阶段。

羊驼免疫的推荐流程:
1.准备抗原:一只羊驼可以同时免疫1-5个抗原,每次免疫总的抗原量保持在1-2mg之间,体积在2mL以下,将抗原和佐剂1:1乳化使其形成均匀混合物,4°保存。
2.免疫羊驼:挑选好羊驼并确保动物适合,记录耳号后开始免疫实验。每次在羊驼颈部淋巴结附近分左右两侧注射,每侧分2点注射,每点注射0.4mL混合好的抗原。免疫后观察半小时确认羊驼状态良好,无不适症状。每2周免疫一次,一共进行7次免疫。

3.采血:在第6、7次免疫后间隔5-7天进行采血,采血从羊驼颈部静脉采取,每次取25 - 30mL血液,分3个采血管收集。

4.血清分离:在第4、5、6次免疫前进行采血用于免疫评价,采血从羊驼颈部静脉采取,每次取5mL血液;血液当天使用预冷25度离心机,400 xg离心30分钟,分离保存上层血清。
5.分离淋巴细胞:在15mL的离心管中先加入3mL细胞分离液,然后缓慢加入3mL血液。加入血液时小心缓慢以防止血液和分离液混匀。之后离心机预冷至25度,400 xg离心30分钟后,观察离心管中血液分离情况,用200ul移液器小心吸取出中间棉状上层免疫细胞至新的15ml离心管中,上层血清保存在新的离心管中,-80度保存。每管加入室温放置的10mL PBS缓冲液,25度,400 xg离心20分钟。去除上清液,每管加入室温放置的5mL PBS缓冲液,25度,400 xg离心20分钟。使用血球计数板计算细胞数目。去除上清液,根据细胞数目使用RNAiso Plus溶解分离得到的淋巴细胞得到107/mL溶解液,-80度保存。
免疫技巧:
1.羊驼的选择是免疫实验效果的关键。选择健康强壮、精神状态良好、体型适中的羊驼,挑选的羊驼毛色光亮,无受伤不适症状可以极大增强免疫的效果。挑选好动物,先预养1周左右以淘汰有些不合格的动物,使后期的实验能顺利进行。

2.淋巴细胞的分离:及时的细胞分离可以有效阻止血液采集后的溶血以及达到最好的分离效果。
3.免疫周期的选择可以影响免疫效果,根据经验,1-2周免疫间隔可以使羊驼对大部分抗原有良好的免疫反应。

构建噬菌体推荐流程:
1.RNA提取:将用Trizol保存的外周血淋巴细胞转移至1.5mL的离心管,加入1/5体积的氯仿混匀;室温静置5分钟后4度12000g离心15分钟;小心将离心后的上清液转移到新的离心管;往新离心管中加入0.5-1倍体积的异丙醇;室温静置10分钟后4度12000g离心10分钟;使用与Trizol保存的外周血淋巴细胞等体积的75%乙醇清洗沉淀,4度7500g离心5分钟后溶解于适量的无RNA酶的水中。
2.反转录cDNA:按照反转录试剂盒说明书将上一步得到的RNA反转录成cDNA。
3.扩增抗体片段:从反转录的cNDA中扩增特定的抗体片段使用Taq DNA Polymerase Hot Start酶进行PCR扩增。
PCR反应体系为:cDNA模板 2ul,ALPVH-C引物2ul,CALL002引物 2ul,10X Taq Buffer 5ul,dNTP 4ul, Taq(HS) 0.25ul,ddH2O补足到50ul。PCR的反应条件为:98度 3分钟;95度 30秒,57度30秒,68度 40秒,每个循环增加2秒,重复22个循环;68度5分钟。将得到的PCR扩增产物跑琼1%脂糖凝胶电泳,可以看到一条1.0kb左右一条0.7kb左右的两条条带,对0.7kb大小的条带切胶使用天根DNA纯化回收试剂盒按说明书回收。
从上一步PCR扩增并回收后DNA片段中再次扩增特定的抗体片段使用Taq DNA Polymerase Hot Start Version酶进行PCR扩增。PCR反应体系为:DNA模板 2ul,Rvhh-FP引物 2ul,Rvhh-RP引物 2ul,10X Taq Buffer 5ul, dNTP 4ul, Taq(HS) 0.25ul, ddH2O补足到50ul。PCR的反应条件为:98度 3分钟;95度 50秒,55度30秒,72度 40秒,重复12个循环;72度10分钟。将得到的PCR扩增产物使用DNA纯化回收试剂盒按说明书回收。

4.克隆至噬菌体质粒:将上一步扩增得到的抗体基因序列和噬菌体载体使用BglI酶切,酶切体系为:扩增基因12ug或者载体3ug, 10X BglI Buffer 3ul, BglI 4.5ul, 补足水到30ul。酶切在37度反应3-4小时。酶切后使用DNA纯化回收试剂盒按说明书回收载体和扩增基因后进行连接反应。连接反应体系为:载体 200ng,扩增基因 80ng,T4连接酶 2ul,10X连接缓冲液 5ul,加水直至50ul。在4度过夜反应。将连接产物使用DNA纯化回收试剂盒按说明书回收,并使用超纯水溶解。
5.转化SS320:将电转杯置于冰上预冷,待SS320感受态细胞融化后加入1ul回收后的连接产物,将混合后的感受态细胞和连接产物转移到预冷好的电转杯中,使用电转仪预设的Bacteria转化程序电击转化,电转后立即往电转杯中加入1mL SOC培养基,将细胞37度复苏60分钟后涂在含有四环素和氨苄抗性的LB培养板上过夜生长。
将上一步过夜生长后的培养板上的细胞用LB培养基和涂布棒冲洗刮下,加入20%的甘油后保存在-80度。

6.扩增和纯化噬菌体文库:将上一步刮下的数目约为10^9个细胞转移到100mL预先加入四环素和氨苄抗生素的2X YT培养液中,37度220rpm培养直至OD600达到0.5。按照辅助噬菌体:细菌细胞数目为20:1的比例加入辅助噬菌体后继续37度培养30分钟。加入终浓度为的卡那霉素和0.2mM 的IPTG,30度过夜培养。
将过夜培养的细胞4度13000rpm离心5分钟,将上清转移到新的离心管后加入1/4体积预冷的 5X PEG8000/NaCl,在冰上孵育30分钟。4度13000rpm离心10分钟去除上清后加入1mL PBS缓冲液溶解沉淀。再次加入250ul 5X PEG8000/NaCl 后冰上孵育10分钟,4度16000g离心15分钟后去除上清并将沉淀溶解在1mL PBS中得到噬菌体库。
构建噬菌体库技巧:
1.噬菌体文库的容量和多样性衡量文库质量的重要标准之一,容量越大、多样性越好的库是成功筛选出抗体的有效保证;
2.影响文库容量和多样性的关键点包括:提取RNA过程中RNA的降解、反转录过程中的模板和引物、扩增过程中模板的用量和PCR扩增轮数、感受态的效率、连接体系的大小等因素;
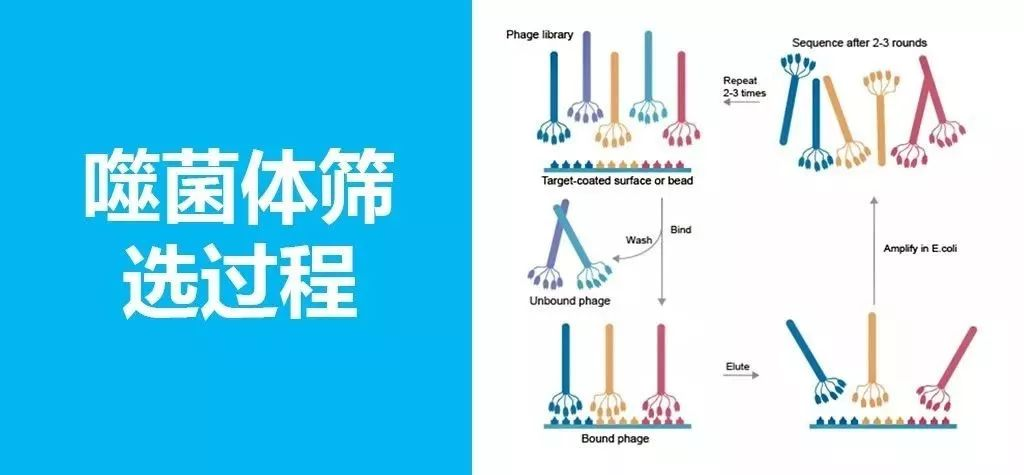
抗体筛选鉴定推荐流程:
1.包被免疫管:将100ug 抗体加入到2mL PBS中并加入到免疫管中,4度过夜孵育。
2.封闭:将扩增和纯化噬菌体文库后的噬菌体 500ul 加入到1mL 3% BSA中,室温旋转孵育2h。同时往包被好的免疫管中加入2-3mL 3% BSA,室温旋转孵育2h。
3.抗原和噬菌体孵育:将封闭后的免疫管用含有0.01%吐温的PBS洗3次,每次5分钟。将封闭后的噬菌体文库加入到封闭后的免疫管中,添加PBS直至2-3mL,室温旋转孵育1h。
4.清洗:将抗原和噬菌体孵育后的免疫管用含有0.01%吐温的PBS洗20次,每次5分钟。
5.洗脱:往免疫管中加入1mL 100mM Trimethymime,室温孵育10分钟,加入1M Tris-HCl中和Trimethymime,将最后1.5mL的洗脱噬菌体转移到新的离心管中。
将洗脱的噬菌体按照扩增和纯化噬菌体文库 扩增后再重复筛选过程2次,逐次减半包被免疫管的抗体量,得到3次筛选后的洗脱噬菌体。
6.ELISA鉴定:将上一步筛选得到的噬菌体稀释10^6倍后,取100ul加入到OD600为0.5的SS320菌液中,37度培养30分钟后涂布含有四环素和氨苄霉素的2X YT培养板上,37度过夜培养第二天得到单克隆菌落。
挑选96个单克隆菌落到含有四环素和氨苄霉素的2X YT培养液的96孔细胞培养板上,37度培养3-4小时后往培养孔中加入卡那霉素和20:1的辅助噬菌体,30度过夜培养。第二天将过夜培养后的细胞液离心,获得上清液。
将过夜包被抗原和用3%BSA封闭过后的96孔ELISA板中加入上一步获得的噬菌体上清液,室温孵育1h。用含有0.05%吐温的PBS清洗3次后,用噬菌体抗体抗体作为一抗,用相应的二抗TMB显色后在波长450读取每个孔的吸光值。选取吸光值读数最高的SS320菌落送去测序,得到抗体的基因序列。
抗体筛选技巧:
1. 合适量的抗原包被和抗原的分子量大小、疏水亲水性质、结构有关,也和包被缓冲液和包被介质的选择有关,合理的包被是成功筛选的基础,如果有必要可以进行预实验确定包被的条件。
2. 洗脱后测定噬菌体的效价,经过2-4轮包被后筛选的富集程度需要在合理范围之内。












