产品搜索
结构搜索
全站搜索
当前位置: 专题聚焦
合成生物学新进展:在烟草细胞中重构紫杉醇生物合成早期途径
本文转自 植物生物技术Pbj
紫杉醇是FDA批准的抗癌药物,已用于治疗多种癌症。紫杉醇属于红豆杉属二萜类化合物紫杉烷类化合物,已报道其结构超过500种。尽管紫杉醇在临床应用方面取得了成功,但由于紫杉醇的在红豆杉中的丰度较低,促使人们广泛研究可替代和可持续的生产方法。
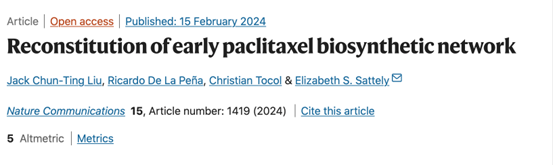
来自斯坦福大学的Elizabeth Sattely团队在用植物工程解决人类健康问题上有了新的发现,于2024年2月15馹在国际知名期刊nature communications上发表了一篇名为“Reconstitution of early paclitaxel biosynthetic network”的研究论文,该研究确定了 T5αH 催化的4个氧化紫杉烯产物的结构,它们的结构表明 T5αH进一步氧化紫杉烯 -5α-醇(2)和 OCT(3)等初级产物。他们还证明过表达的 T5αH可以直接氧化紫杉烯 -5α-醇(2)。因此,作者认为 T5αH的过度表达是其催化混杂的原因之一。通过调节本氏烟中 T5αH 的表达水平,能够增加氧化后的紫杉二烯中紫杉二烯 -5α-醇(2)的比例,减少混杂副产物的形成。利用这个优化的系统,作者重建了一个早期紫杉醇生物合成网络,其中包含6种特征化的红豆杉酶,而获得这些早期的紫杉醇生物合成中间体将有助于将来发现缺失的生物合成酶。
在紫杉醇的生物合成途径中,紫杉烯合成酶(TS)将香叶基香叶基焦磷酸酯(GGPP)转化为紫杉烯(1),紫杉烯5α-羟化酶(T5αH,蓝色圆圈)可将其氧化为紫杉烯 -5α-醇(2)。紫杉烯 -5α-醇(2)通常被认为是紫杉醇生物合成的前体,将紫杉烯 -5α-醇(2)氧化为紫杉醇的酶有许多种,目前12种已知,5种未知(图1a)。将T5αH基因在烟草中异源表达,质谱结果结果显示:T5αH蛋白催化产生了多种催化产物(图1b),T5αH对异源表达的催化混杂性一直是紫杉醇生物合成途径重建的瓶颈,因为它降低了向紫杉醇 -5α-醇(2)的代谢通量,并且多种氧化产物可能使产物解卷积复杂化。
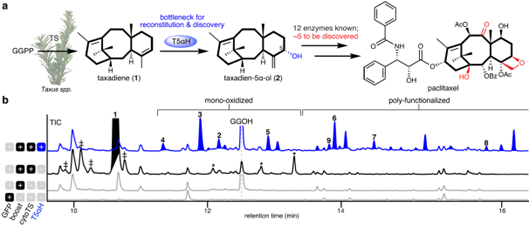
图1: T5αH 催化混杂是紫杉醇生物合成路径重构和发现的瓶颈
给表达 T5αH 的本氏烟草叶片涂抹化合物2,观察到2至9的化合物产物的量发生了变化(图2d)。质谱结果显示:化合物9是二氧化物产物,在超表达T5αH 的本氏烟草系统中是积累的次要产物(图1b)。过度氧化产物(如9)的形成不仅使产物2得率减少,而且使途径重建复杂化: 当下一个生物合成基因 TAT 与本生烟草中的 TS 和 T5αH 共表达时,我们观察到两个新的峰10和11和两个消失的产物 2和9(图2e) ,表明 TAT 能够接受2和9作为底物。作者认为:过度氧化是由于在烟草中高水平的 T5αH导致氧化循环解偶联和蛋白质错误折叠所引起的活性缺失。鉴于这些结果,作者认为降低 T5αH 的蛋白水平可能可以减轻过度氧化,使产物向化合物2积累,从而提高紫杉醇前体的量。
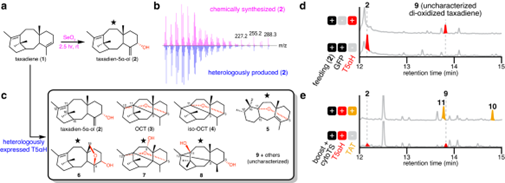
图2: T5αH 催化产物结构解析
为了降低 T5αH 蛋白水平,作者用了两种较弱的组成型启动子-泛素 -10(UBQ10)和诺帕林合酶(NOS)启动子来驱动T5αH在烟草中的超表达,分别得到35S 启动子表达水平的75% 和63%。调节 T5αH 转录水平减轻过度氧化,在 UBQ10或 NOS 启动子下 T5αH 的表达大大抑制了过度氧化的紫杉二烯的形成,在NOS系统中化合物2的得率最高(图3a)。紫杉二烯(1)在所有三种表达系统中都被耗尽,表明 T5αH 的较低表达并不影响它对1的利用。通过将总离子色谱(TIC)上每个氧化产物的峰面积积分并除以总积分面积,作者计算了每个产物的百分比作为产物分布的近似值(图3b),UBQ10启动子和 NOS 启动子分别使多功能化产物的比例从68% 降至37% 和25% 。虽然较弱的启动子降低了多功能化产物的丰度,但四种主要单氧化紫杉二烯(2/3/4/5)之间的比例基本保持不变(图3c)。
图3: 降低 T5αH 表达水平可减少紫杉烯多样化的形成
通过构建不同的共表达体系,作者提出紫杉醇前体的生物合成途径通过 TAT 和 T13αH 的作用。作者将 T13αH 与所有的酶(TS、 T5αH、趋化因子、 T10βH 和 DBAT)一起测试,在烟草中进行共表达,看看是否能形成新的产物。作者发现:共表达6种酶的产物,化合物15是由内源性烟草酶氧化而不是由 T13αH 氧化的结果(图4)。化合物14的产生和结构结构解析也首次提供了证据:6种红豆杉生物合成酶(TS、 T5αH、 TAT、 T10βH、 DBAT 和 T13αH)正在同步合成早期紫杉醇中间体。
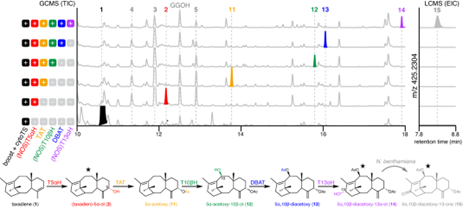
图4: 在本氏烟草中进行早期紫杉醇生物合成途径的重建
虽然作者观察到提出的底物/产物对的消失和出现,从 T5αH,TAT... 到 T13αH 顺序引入生物合成酶,并将途径说明为一系列线性步骤(图4) ,但每种酶的作用顺序仍不清楚。当用纯化的底物进行测试时,已经表明重组 T13αH有效地氧化紫杉烯 -5α-醇(2),以相对于2的6%的转化率水平氧化5α-乙酰氧基紫杉烯(11),并且对5α-乙酰氧基紫杉烯 -10β-醇(12)没有活性。因此,如图5所示,18和20的形成可能分别在11和12经过16而不是 T13αH 的直接氧化。是否13是 T13αH 制备14的直接底物还有待进一步研究。化合物5α-乙酰氧基紫杉醇 -10β-醇(12)和紫杉醇 -5α,13α-二醇(16)已被认为是紫杉醇生物合成早期的相关生物合成中间体,因为要得到紫杉醇应从外源供应的11和2从而产生12和16。检测12和16(13,14,18和20)下游的中间产物也证实了以14作为最终产物的汇聚代谢网络,这将与先前在一个共同的中间体上提出的两个途径分支联合起来。
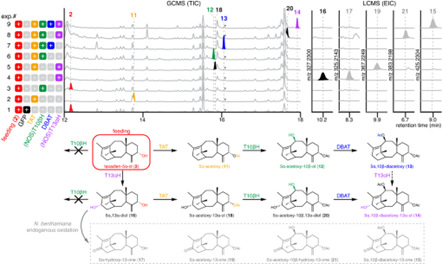
图5: 紫杉醇前体生物合成的代谢网络












