产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
银卡宾:环氧乙烷“变”环丙烷
本文转自x-mol
分子编辑(环骨架中原子的删除、插入以及替换)可以极大增加分子结构多样性,是有机合成转化的重要策略之一。单原子替换作为分子编辑重要的一种反应类型,对功能至关重要的分子特性,如氢键、极性、代谢稳定性、靶标特异性和溶解度等,都可以通过该转化显著调节。同时,在药物分子筛选阶段使用该策略能够更高效地获取复杂结构类似物,无需从起始原料开始,从而极大缩短药物的合成周期。然而,单原子替换转化往往需要繁琐的步骤,而且代价高昂。在这方面,Mark D. Levin教授团队有两例令人振奋的C-to-N单原子替换报道:1)通过氮宾内化(nitrene internalization)过程获得多种吡啶异构体(Science, 2023, 381, 1474,点击阅读详细),实现可定点的芳环C-to-N替换反应;2)将氮杂芳烃通过序列的氧化、光照以及臭氧分解等操作,一步将喹啉转化为相应的喹唑啉衍生物,实现碳原子向氮原子的直接转化(Nature, 2023, 623, 77-82,点击阅读详细)。为了应对药物开发带来的需求和挑战,精确操控单个原子的替换转化仍有大量的工作要做。由于三元环的构象稳定性和氟烷基带来的独特性质,氟烷基环丙基成为了具有药用潜力的新生物活性分子中引人注目的结构单元。鉴于环丙烷在合成和药物化学中的核心地位,将环氧化物转化为环丙烷(即氧-碳原子替换)的研究再次受到关注。到目前为止,合成化学家已经开发了四种方法来实现环氧化物中的氧-碳原子替换(图1a),但这些方法通常反应温度高,产率较低,同时缺乏底物多样性和官能团耐受性。为了拓宽这种转化的应用范围以及获得合成官能化环丙烷的温和条件,这些难点对于高效、原子经济性的催化体系的建立以及卡宾前体的选择提出了要求。
东北师范大学毕锡和课题组原创性开发了易分解N-邻三氟甲基苯磺酰腙,作为安全稳定的卡宾前体实现了多种卡宾转移反应,解决了传统对甲基苯磺酰腙分解温度高、难以应用于低温反应的问题,开拓了磺酰腙卡宾化学研究新领域(Acc. Chem. Res. 2022, 55, 1763,点击阅读详细)。近期,该团队报道了一种银催化的高效O-to-C的替换反应,使用氟烷基-N-邻三氟甲基苯磺酰腙作为单碳原子试剂,在温和条件下将环氧化物一步转化为环丙烷(图1b)。该方法具有操作简单、官能团耐受性和产物结构多样性好等优点,以高产率和高非对映选择性获得三氟甲基环丙烷。
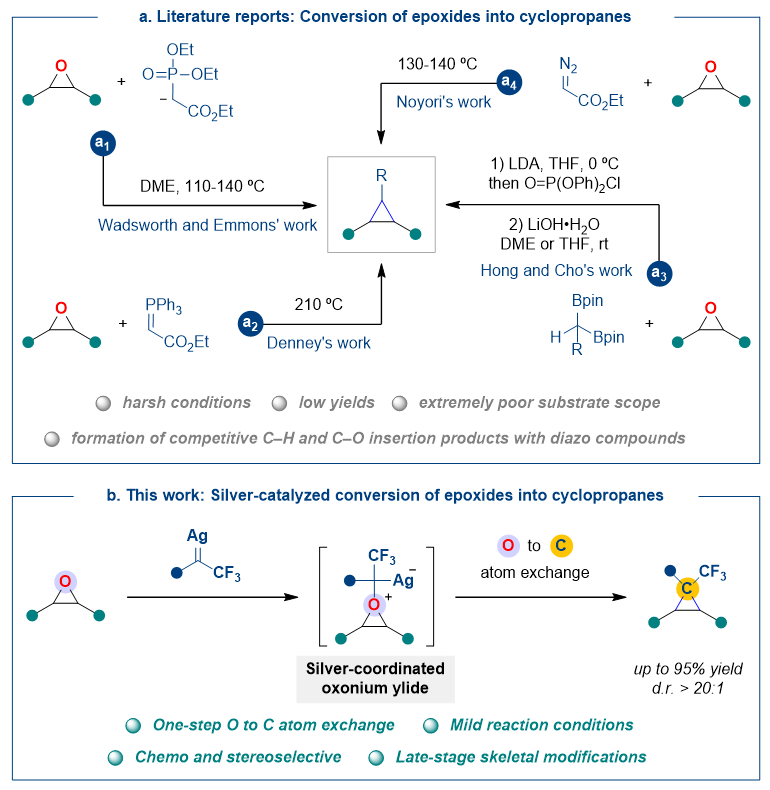
图1. 研究背景与反应设计。图片来源:Nat. Commun.
首先,作者以2-苄基环氧乙烷作为底物,4-氯苯基三氟甲基-N-邻三氟甲基苯磺酰腙2a作为氟烷基卡宾前体进行条件优化,得到最佳的反应条件为:60 °C下,TpBr3Ag(thf)作为催化剂,NaH作为碱,在二氯甲烷中反应6小时,以92%的收率和10:1的d.r.值得到环丙烷产物3,而没有形成竞争的C–O或C–H键插入副产物(表1)。作者发现TpBr3Ag(thf) 独特的催化性质是由于具有显著空间位阻的蝎形配体(TpBr3)的存在,这不仅阻碍了卡宾二聚副反应的发生,而且提高了反应的非对映选择性。更重要的是,N-邻三氟甲基苯磺酰基腙易于分解的特性,是银卡宾快速脱氧的基础。
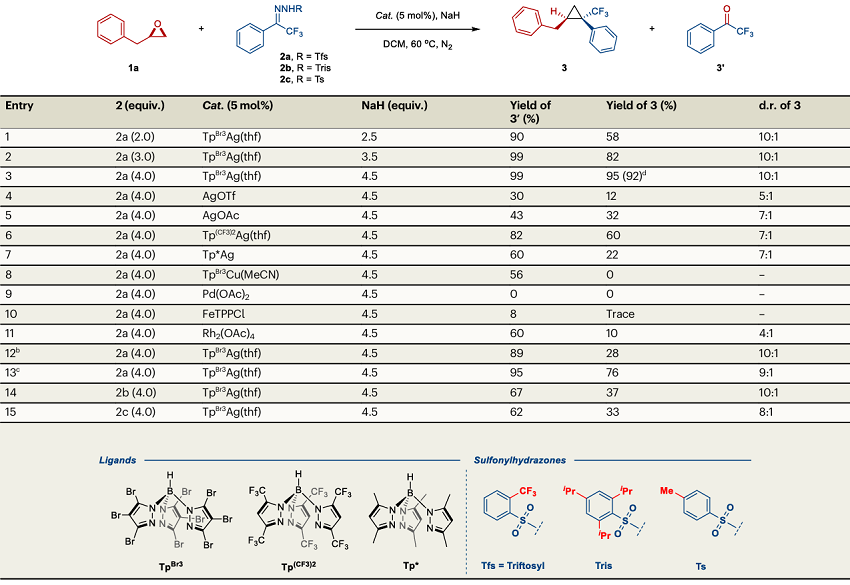
表1. 反应条件优化。图片来源:Nat. Commun.
作者在最优条件下对一系列环氧化物进行了范围探究(图2a)。烷基(甲基、正丁基、正癸基、苄基和2-苯乙基)、醚、酯基、卤素、磺酸酯、烯基以及炔基等基团取代的环氧化物很容易转化为相应的环丙烷产物,具有良好的至优异的产率和良好的d.r.值。3-苯基-2,2′-双环氧化物在延长反应时间的条件下,转化为具有高非对映选择性的双环丙烷16。1,2,7,8-二环氧辛烷作为底物时,控制N-苯磺酰腙的量可以得到18(80%; >12:1 d.r.)和19(74%; 8:1 d.r.)两种产物。作者发现芳基取代的环氧化物的反应活性高于烷基环氧化物,反应30分钟即可完全转化。具有不同电子性质的芳基环氧化物在这种转化中具有良好的耐受性,以高产率和优异的非对映选择性提供环丙烷。作者还考察了二取代环氧乙烷的范围,发现2,2-二取代环氧化物和2,3-二取代的环氧化物是合适的底物。
随后,作者使用氧化苯乙烯作为底物,考察了苯磺酰腙的范围(图2b)。结果显示,无论电子效应如何,单取代、多取代、萘基、呋喃基以及烯基取代的三氟甲基-N-苯磺酰腙都能顺利反应,并且具有优异的非对映选择性。衍生自五氟乙基苯基酮的磺酰腙也成功转化为五氟乙基环丙烷63,证明了本工作在发散合成中的能力。此外,衍生自苯基乙酸乙酯以及芳香醛的苯磺酰腙均是可适用的底物。作者还进行了10.0 mmol规模的转化,证明该方法的稳健性和可扩展性(图2c)。
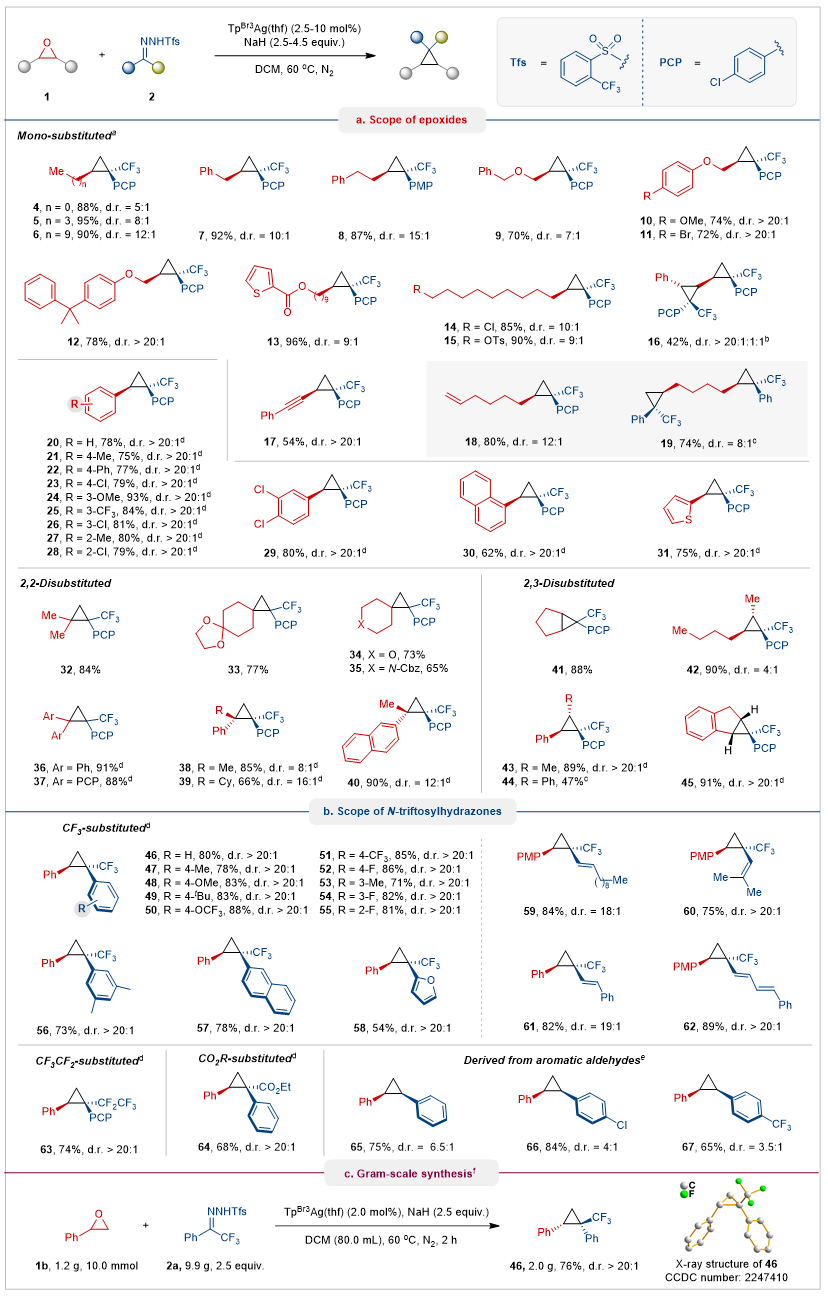
图2. 底物范围。图片来源:Nat. Commun.
紧接着,作者评估了复杂分子在该转化中的适用性(图3)。在标准条件下,从可卡醛、芬布芬、姜酮、萘丁美酮、非诺贝特和丙磺舒衍生的环氧化物很容易以中高产率转化为相应的三氟甲基环丙烷产物(68–72)。此外,衍生自生物活性天然产物(如香茅醇、胆固醇和DL-薄荷醇)和非甾体抗炎药(如吲哚美辛和布洛芬)的N-苯磺酰腙有效地进行了这种氧碳交换反应,以高产率和优异的立体控制得到了环丙烷产物(74–78)。上述转化成功地向药物和天然产物中引入了三氟甲基环丙烷结构单元,展现了该反应与复杂结构的兼容性,证明了其在药物化学与合成化学中的应用潜力。
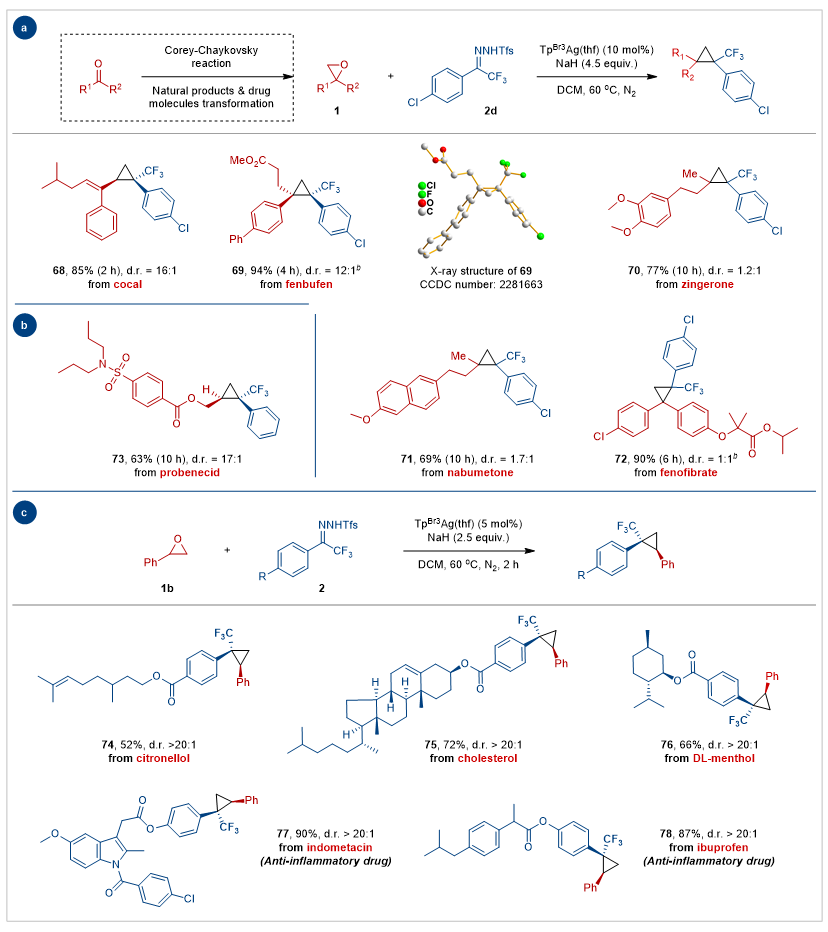
图3. 复杂分子后期修饰。图片来源:Nat. Commun.
为了深入了解反应机理,首先,作者将2-苄基环氧乙烷和氧化苯乙烯分别在没有N-苯磺酰腙的标准条件下搅拌30分钟,以定量产率回收环氧化物(图4a,eq.i),表明环氧化物在该碱性条件下的高稳定性。然而,在N-苯磺酰腙存在的情况下,环氧化合物在5分钟内消失,并产生烯烃中间体和环丙烷,这表明原位产生的银卡宾可能诱导这种有序的脱氧和环加成过程。当反应持续30分钟时,2-苄基环氧乙烷转化为烯丙苯(30%)和环丙烷产物3(68%),而氧化苯乙烯以78%的产率转化为46(图4a,方程式ii和iii),这是因为芳基烯烃具有高于烷基烯烃的反应性。反应6小时后,烯丙苯被完全消耗并转化为环丙烷产物3(图4a,eq.ii)。基于控制实验,作者提出了合理的脱氧/环加成串联反应机理(图4b)。
作者通过密度泛函理论(DFT)计算进一步阐述机理细节,表明最有利的途径是通过环氧化物与过量的银卡宾脱氧原位生成的烯烃的环加成进行氧碳原子替换(图4c)。首先,银卡宾Int1生成后,亲电进攻2-苄基环氧乙烷的氧原子形成叶立德Int2(TS1,∆G≠=1.3 kcal mol-1)。Int2容易通过TS2(∆G≠=2.9 kcal mol-1)进行分子内开环异构化,形成三氟甲基苯乙酮3a和烯丙基苯Int3。最后,Int3与过量的银卡宾Int1的协同[2+1]环加成反应产生环丙烷产物3-syn和3-anti。计算表明,竞争性的烯丙基C–H键插入由于能垒不占优(TS5,∆G≠=3.7 kcal mol-1),优先形成环丙烷产物3-anti和3-syn。
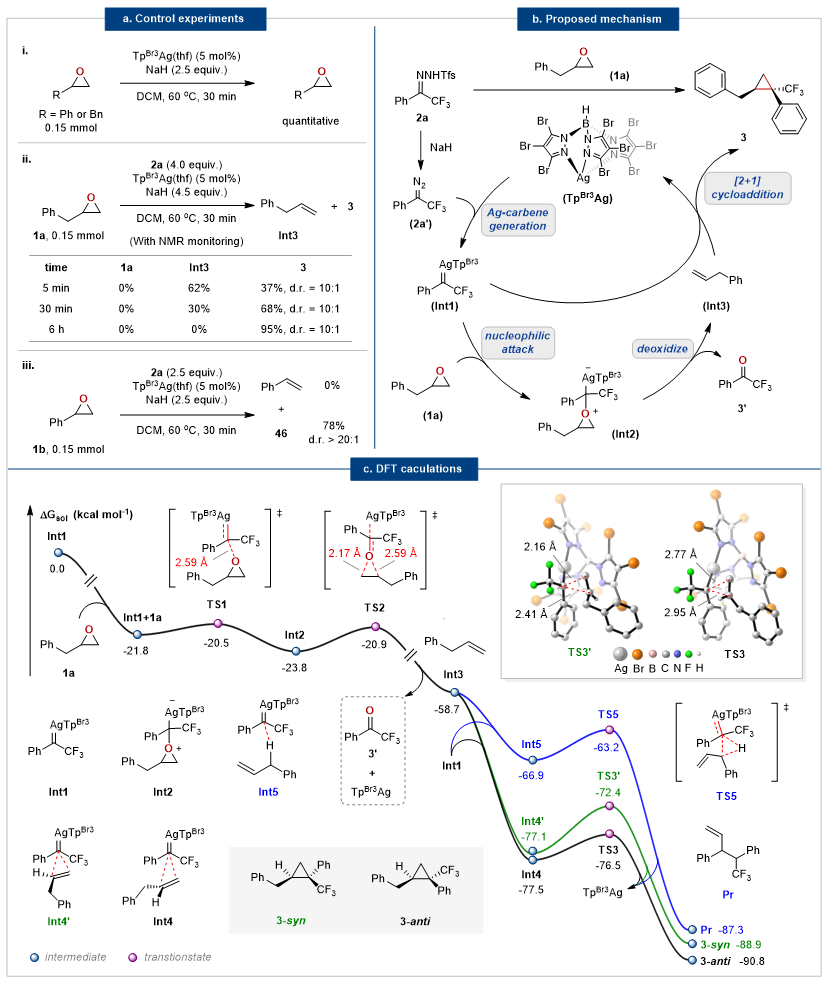
图4. 机理研究。图片来源:Nat. Commun.
根据对3D模型的分析,TS3'中的C–H---F氢键相互作用的数量多于TS3,导致TS3'的空间位阻构型更大,稳定性减弱(图5)。环丙烷化过程的约化密度梯度(RDG)分析表明,TS3具有更强的非共价相互吸引作用,而TS3'中存在更强的空间位阻。因此,3-anti的形成比3-syn更加有利。
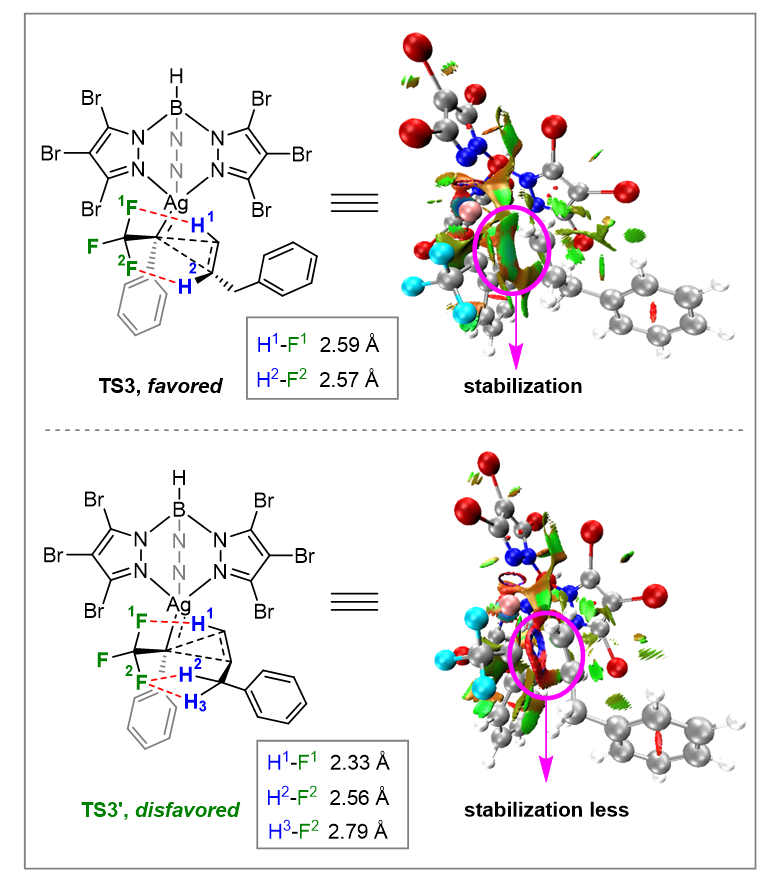
图5. TS3和TS3'的约化密度梯度(RDG)分析。图片来源:Nat. Commun.
小结
毕锡和教授课题组报道了一种用于环氧化物独特、高效的氧-碳单原子替换方法,以氟烷基-N-邻三氟甲基苯磺酰腙作为卡宾前体,在银催化下将环氧化物直接转化为氟烷基环丙烷。该反应效率高,化学和立体选择性优异,官能团兼容性好,并且能成功扩展到药学相关的天然产物和药物的后期功能化。机理实验和DFT计算研究表明,该反应通过银配位的氧鎓叶立德中间体进行脱氧成烯烃,然后过量的银卡宾对烯烃中间体进行[2+1]环加成的串联方式有序进行。
这一成果近期发表在Nature Communications 上,东北师范大学毕锡和教授为通讯作者。博士研究生李林轩为第一作者,硕士研究生卫丹丹、刘梦琳、朱晴雯以及董帅参与了计算以及实验相关工作。该研究工作得到了国家自然科学基金重点项目的支持。












